) образуется кинетически устойчивый фермент-субстратный комплекс;
) константа KS является константой диссоциации фермент-субстратного комплекса: это справедливо, только если 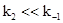 ;
;
) концентрация субстрата не меняется в ходе реакции, т.е. концентрация свободного субстрата равна его начальной концентрации;
) продукт реакции быстро отщепляется от фермента, т.е. не образуется кинетически значимого количества ЕS комплекса;
) вторая стадия реакции необратима; точнее говоря, мы принимаем во внимание только начальную скорость, когда обратной реакцией (из-за фактического отсутствия продукта) еще можно пренебречь;
) с каждым активным центром фермента связывается только одна молекула субстрата;
) для всех реагирующих веществ вместо активностей можно использовать их концентрации. [2]
Уравнение Михаэлиса - Ментен служит отправной точкой при любом количественном описании действия ферментов. Следует подчеркнуть, что кинетическое поведение большинства ферментов значительно сложнее, чем это вытекает из идеализированной схемы, лежащей в основе уравнения Михаэлиса - Ментен. При выводе этого уравнения предполагается, что существует только один фермент-субстратный комплекс. Между тем в действительности в большинстве ферментативных реакций образуется, по меньшей мере, два или три таких комплекса, возникающих в определенной последовательности.
Здесь через EZ обозначен комплекс, соответствующий истинному переходному состоянию, а через ЕР - комплекс между ферментом и продуктом реакции. Можно указать также, что в большинстве ферментативных реакций участвует более одного субстрата и образуется соответственно два или большее число продуктов. В реакции с двумя субстратами, S1 и S2, может образоваться три фермент-субстратных комплекса, а именно ES1, ES2 и ES1S2. Если в результате реакции получается два продукта, P1 и P2, то может существовать, по меньшей мере, еще три дополнительных комплекса EP1, EP2 и EP1P2. В таких реакциях имеется много промежуточных стадий, каждая из которых характеризуется своей константой скорости. Кинетический анализ ферментативных реакций, в которых принимают участие два реагирующих вещества или более, часто оказывается исключительно сложным и требует использования электронных вычислительных машин. Тем не менее, при анализе кинетики всех ферментативных реакций отправной точкой всегда является рассмотренное выше уравнение Михаэлиса - Ментен. [5]
 TimeBiology
TimeBiology