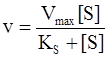Предварительные эксперименты по изучению кинетики ферментативных реакций показали, что скорость реакции  , вопреки теоретическим ожиданиям, не зависит от концентрации фермента (Е) и субстрата (S) таким образом, как в случае обычной реакции второго порядка.
, вопреки теоретическим ожиданиям, не зависит от концентрации фермента (Е) и субстрата (S) таким образом, как в случае обычной реакции второго порядка.
Браун и независимо от него Анри впервые выдвинули гипотезу об образовании в ходе реакции фермент-субстратного комплекса. Затем это предположение подтвердили три экспериментальных факта:
а) папаин образовывал нерастворимое соединение с фибрином (Вюртц, 1880);
б) субстрат инвертазы сахароза могла защищать фермент от тепловой денатурации (О'Салливан и Томпсон, 1890);
в) было показано, что ферменты являются стереохимически специфическими катализаторами (Фишер, 1898-1899).
В 1913 г. Михаэлис и Ментен опубликовали свою теорию общего механизма ферментативных реакций:
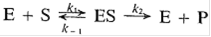
Они ввели понятие максимальной скорости и показали, что кривая насыщения (т.е. зависимость скорости реакции от концентрации субстрата) является равнобочной гиперболой. Они доказали, что максимально наблюдаемая скорость есть одна из асимптот к кривой, а отрезок, отсекаемый на оси абсцисс (в области ее отрицательных значений) второй асимптотой, т.е. константа в уравнении скорости, равен по абсолютному значению концентрации субстрата, необходимой для достижения половины максимальной скорости. [2]
Михаэлис и Ментен предположили, что скорость реакции определяется распадом комплекса ES, т.е. константой k2. Это возможно только при условии, что k2 - наименьшая из констант скорости. В этом случае равновесие между фермент-субстратным комплексом, свободным ферментом и субстратом устанавливается быстро по сравнению со скоростью реакции (быстро устанавливающееся равновесие).
Начальную скорость реакции можно выразить следующей формулой:
v = k2 [ES]
Поскольку константа диссоциации фермент-субстратного комплекса равна
KS = [E] [S] / [ES] = k -1/k1
то концентрацию свободного фермента можно выразить как
[E] =KS [ES] / [S]
Общая концентрация фермента в реакционной смеси определяется формулой
[Е]т = [Е] + [ЕS] = KS [ЕS] / [S] + [ЕS]
Реакция достигает максимальной скорости, когда концентрация субстрата достаточно высока, чтобы все молекулы фермента находились в виде комплекса ЕS (бесконечно большой избыток субстрата). Отношение начальной скорости к теоретически возможной максимальной скорости равно отношению [ЕS] к [Е]т:
v / Vmax= [ES] / [E]т= [ES] / (KS [ES] / [S] + [ES]) = 1 / (KS+[S] +1)
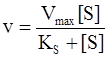
Это классическое уравнение Михаэлиса и Ментен, которое со времени его публикации в 1913 г. стало фундаментальным принципом всех кинетических исследований ферментов в течение десятилетий и с некоторыми ограничениями осталось таким до сих пор. [5]
Позднее было показано, что оригинальное уравнение Михаэлиса - Ментен предполагало наличие нескольких ограничений. Оно справедливо, т.е. правильно описывает кинетику реакции, катализируемой данным ферментом, только при условии выполнения всех следующих ограничительных условий:
 TimeBiology
TimeBiology