Пусть в некоторый момент времени нам удалось загнать все молекулы с помощью диафрагм (перегородок) в правую верхнюю часть сосуда. Остальные 3/4 объема сосуда оставались при этом пустыми. Далее уберем диафрагмы и увидим, что молекулы заполнят весь объем сосуда, то есть перейдут из состояния с меньшей вероятностью в состояние с большей вероятностью. То есть процессы в системе идут только в одном направлении: от некоторой структуры (порядка, когда все молекулы содержались в верхнем правом углу объема сосуда) к полной симметрии (хаосу, беспорядку, когда молекулы могут занимать любые точки пространства сосуда).
купите перегородка лофт в спальню
Больцман первым увидел связь между энтропией и вероятностью. При этом он понял, что энтропия должна выражаться через логарифм вероятности. Ибо если мы рассмотрим, скажем, две подсистемы одной системы, каждая из которых характеризуется статистическим весом, соответственно W1 и W2, полный статистический вес системы равен произведению статистических весов подсистем:
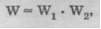
в то время как энтропия системы S равна сумме энтропии подсистем:
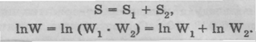
Больцман связал понятие энтропии S с InW. В 1906 году Макс Планк написал формулу, выражающую основную мысль Больцмана об интерпретации энтропии как логарифма вероятности состояния системы:
S = k lnW
Коэффициент пропорциональности к был рассчитан Планком и назван постоянной Больцмана. Формула "S = k lnW" выгравирована на памятнике Больцману на его могиле в Вене.
Идея Больцмана о вероятностном поведении отдельных молекул явилась развитием нового подхода при описании систем, состоящих из огромного числа частиц, впервые развитого Максвеллом. Максвелл пришел к пониманию того, что в этих случаях физическая задача должна быть поставлена иначе, чем в механике Ньютона. Очевидно, что наш пример с мечеными молекулами сам по себе неосуществим, ибо в принципе невозможно проследить в течение значительного интервала времени за движением отдельной молекулы. Невозможно также определить точно координаты и скорости всех молекул макроскопического тела одновременно в данный момент времени. Задачу следует ставить иначе, а именно - попытаться найти вероятность того, что данная молекула обладает таким-то значением скорости. Максвелл ввел для описания случайного характера поведения молекул понятие вероятности, вероятностный (статистический закон). Используя новый подход, Максвелл вывел закон распределения числа молекул газа по скоростям. Этот закон вызвал длительную дискуссию, длившуюся десятилетия вплоть до изготовления молекулярных насосов, позволивших произвести экспериментальную проверку закона. В 1878 году Больцман, как уже говорилось, применил понятие вероятности, введенное Максвеллом, и показал, что второй закон термодинамики также является следствием более глубоких статистических законов поведения большой совокупности частиц.
Таким образом, с развитием статистической физики и термодинамики на место причинных динамических законов становятся статистические законы, позволяющие предвидеть эволюцию природы не с абсолютной достоверностью, а лишь с большой степенью вероятности.
Перейти на страницу:
1 2 3
 TimeBiology
TimeBiology