В 1865 году Клаузиус ввел новое понятие "энтропия" (entropia - от греч. "поворот", "превращение"). Клаузис посчитал, что существует некоторая величина S, которая, подобно энергии, давлению, температуре, характеризует состояние газа. Когда к газу подводится некоторое количество теплоты , то энтропия S возрастает на величину, равную
, то энтропия S возрастает на величину, равную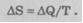
В течение длительного времени ученые не делали различий между такими понятиями, как температура и теплота. Однако ряд явлений указывал на то, что эти понятия следует различать. Так, при таянии льда теплота расходуется, а температура льда не изменяется в процессе плавления. После введения Клаузиусом понятия энтропии стало понятно, где пролегает граница четкого различения таких понятий, как теплота и температура. Дело в том, что нельзя говорить о каком-то количестве теплоты, заключенном в теле. Это понятие не имеет смысла. Теплота может передаваться от тела к телу, переходить в работу, возникать при трении, но при этом она не является сохраняющейся величиной. Поэтому теплота определяется в физике не как вид энергии, а как мера изменения энергии. В то же время введенная Клаузиусом энтропия оказалась величиной, сохраняющейся в обратимых процессах. Это означает, что энтропия системы может рассматриваться как функция состояния системы, ибо изменение ее не зависит от вида процесса, а определяется только начальным и конечным состояниями системы.
Покажем, что в идеальном цикле Карно энтропия сохраняется.
Рассмотрим

Из этого соотношения следует, что энтропия рабочего тела на 1-й стадии возрастает ровно настолько, насколько она уменьшается на 3-й стадии. На 2-й и на 4-й стадиях энтропия рабочего тела не изменяется, так как процессы здесь протекают адиабатически, без теплообмена.
Иными словами, в случае обратимых процессов, то есть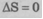 , S = const - энтропия изолированной системы в случае обратимых процессов постоянна.
, S = const - энтропия изолированной системы в случае обратимых процессов постоянна.
При необратимых процессах получаем закон возрастания энтропии:
Для того чтобы осуществить обратимый процесс, необходимо, как это уже упоминалось, добиться очень медленного расширения или сжатия рабочего тела, чтобы изменения системы представляли собой последовательность равновесных состояний. В таком цикле совершение какой-либо полезной работы потребует бесконечно большого времени. Чтобы получить работу в короткие промежутки времени, то есть хорошую мощность, приходится нарушать условия идеального цикла. А это сразу приведет к неодинаковости температуры на разных участках системы, к потокам тепла от более горячих участков к менее горячим, то есть к возрастанию энтропии системы.
Для описания термодинамических процессов I начала термодинамики оказывается недостаточно, ибо I началотермодинамики не позволяет определить направление протекания процессов в природе. Тот факт, что энтропия изо лированной системы не может убывать, а только возрастает и достигает максимального значения в равновесном состоянии, является отражением того, что в природе возможны процессы, протекающие только в одном направлении - в направлении передачи тепла только от более горячих тел менее горячим.
Существуют различные формулировки II начала термодинамики. Все они являются эквивалентными. Приведем некоторые из них:
Перейти на страницу:
1 2 3
 TimeBiology
TimeBiology