Если в ходе реакции происходит образование кинетически устойчивого комплекса фермент - продукт, механизм реакции выглядит следующим образом:
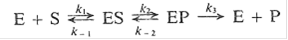
Применив предположение о стационарном состоянии, можно написать дифференциальные уравнения:
d [ES] /dt = k1 [E] [S] + k-2 [EP] - (k-1 + k2) [ES] = 0[EP] /dt = k2 [ES] - (k-2 + k3) [EP] = 0
Из этих уравнений следует, что
[ES] = [(k-2 + k3) / k2] [EP]
[E] = [(k-1 k-2 + k-1 k-3 + k2k3) / k1k2 [S]] [EP]
Так как v = k3 [EP]
и [E]T = [E] + [ES] + [EP] =
= [(k-1 k-2 + k-1 k-3 + k2k3) / k1k2 [S] + (k-2 + k3) / k2 + 1] [EP] =
= {[k-1 k-2 + k-1 k-3 + k2k3 + k1 [S] (k-2 + k3) + k1k2 [S]] / k1k2 [S]} [EP]
получаем
[EP] = k1k2[S] [E]T / [k-1 k-2 + k-1 k-3 + k2k3 + k1 [S] (k-2 + k3 + k2)]= k1k2k3[S] [E]T / [k-1 k-2 + k-1 k-3 + k2k3 + k1 [S] (k-2 + k3 + k2)] =
= [k2k3 / (k-2 + k3 + k2)] [E]T[S] / [(k-1 k-2 + k-1 k-3 + k2k3) / k1 (k-2 + k3 + k2) + [S]]
То есть
Vmax = [k2k3 / (k-2 + k3 + k2)] [E]Tm = (k-1 k-2 + k-1 k-3 + k2k3) / k1 (k-2 + k3 + k2)
В этом случае уже очень сложно вычислить конкретные значения индивидуальных констант скорости, так как прямо измерить можно только их отношение. Ситуация еще более затрудняется при усложнении механизма ферментативной реакции, когда в реакции участвуют больше двух комплексов, потому что количество констант скорости в уравнении, естественно, гораздо больше, и их соотношения также сложнее. [2]
Однако ситуация упрощается, если после обратимой реакции образования первого комплекса последующие элементарные стадии необратимы. Важными представителями ферментов, подчиняющихся этому механизму, являются протеолитические ферменты и эстеразы. Механизм их реакции можно записать следующим образом:
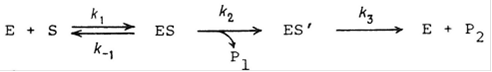
где ES` - ацилферментное промежуточное соединение, которое разлагается под действием воды. Мы можем написать
d [P2] /dt = d [P1] / dt = v = k1k2k3 [S] [E]0 / [k3(k-1 + k2) + [S] (k2 + k3)]
Vmax = k2k3 [E]0 / (k2 + k3) = kкат [E]0m = k3 (k-1 + k2) / (k2 + k3) k1кат / Km = k2k1 / (k-1 + k2) = k2 / Km’
Константа Михаэлиса стадии ацилирования - Km'  Ks. Чем больше отношение kкат/Km, тем выше специфичность субстрата. [5]
Ks. Чем больше отношение kкат/Km, тем выше специфичность субстрата. [5]
Определение констант значительно упрощается, если эксперимент проводят в присутствии нуклеофильного агента (N), способного конкурировать с водой. Тогда
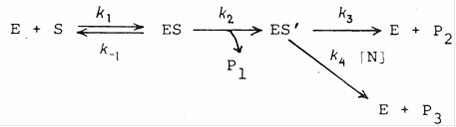
k3 = k3’ [H2O] и Pi (i = 1, 2, 3) - продукты.
vi = kкат, i [E0] [S] / (Km + [S])кат, 1 = k2 (k3 + k4 [N]) / (k2 + k3 + k4 [N])кат, 2 = k2k3 / (k2 + k3 + k4 [N])кат, 3 = k2k4 [N] / (k2 + k3 + k4 [N])m = Ks (k3 + k4 [N]) / (k2 + k3 + k4 [N])
/vN = Ks (k3 + k4 [N]) / k2k3 [S] [E0] + (k2 + k3 + k4 [N]) / k2k3 [E0]
Так как известно, что Ks/k2 = Km/ kкат, и если нуклеофил отсутствует, то
1/v = Ks / k2 [S] [E0] + (k2 + k3) / k2k3 [E0]
и для определения констант можно использовать точку пересечения прямых в координатах 1/vN (и 1/v) - 1/[S]. Две прямые линии в двойных обратных координатах пересекаются во втором квадранте. В отсутствии нуклеофила точка пересечения прямой с вертикальной осью определяется как 1/Vmax и 1/kкат[E0], а с горизонтальной осью - как -1/Km. Координаты точки пересечения двух прямых: -1/Ks и 1/k3[E0]. Расстояние между 1/Vmax и 1/k3[E0] равно 1/k2[E0].
 TimeBiology
TimeBiology
