Среди белков мышечной ткани выделяют три основные группы: саркоплазматические белки, на долю которых приходится около 35 %, миофибриллярные белки, составляющие около 45 %, и белки стромы, количество которых достигает 20 %.
Саркоплазматические белки растворимы в воде и слабых солевых растворах. Основную массу их составляют белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы окислительного фосфорилирования, а также многие ферменты гликолиза, азотистого и липидного обменов, находящиеся в саркоплазме. К этой группе относится также белок миоглобин, который связывает кислород с большим сродством, чем гемоглобин, и депонирует молекулярный кислород в мышцах. В последнее время открыта группа саркоплазматических белков парвальбуминов, которые способны связывать ионы кальция, однако их физиологическая роль остается невыясненной.
Миофибриллярные белки включают сократительные белки миозин, актин и актомиозин, а также регуляторные белки тропомиозин, тропонин, α- и β-актинины. Миофибриллярные белки обеспечивают сократительную функцию мышц.
Миозин является одним из основных сократительных белков мышц, составляющий около 55 % общего количества мышечных белков. Из него состоят толстые нити (филаменты) миофибрилл. Молекулярная масса этого белка - около 470 000. В молекуле миозина различают длинную фибриллярную часть и глобулярные структуры (головки). Фибриллярная часть молекулы миозина имеет двуспиральную структуру (рис. 2).
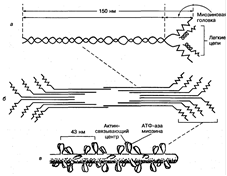
Рис. 2. Схема строения молекулы миозина (а), миозинового пучка (б) и миозиновой толстой нити (в)
В составе молекулы выделяют шесть субъединиц: две тяжелые полипептидные цепи (молекулярная масса 200 000) и четыре легкие цепи (молекулярная масса 1500-2700), расположенные в глобулярной части. Основной функцией фибриллярной части молекулы миозина является способность образовывать хорошо упорядоченные пучки миозиновых филаментов или толстые протофибриллы. На головках молекулы миозина расположены активный центр АТФ-азы и актинсвязывающий центр, поэтому они обеспечивают гидролиз АТФ и взаимодействие с актиновыми филаментами.
Молекула миозина содержит значительное количество глутаминовой аминокислоты и имеет большой отрицательный заряд, что усиливает связывание свободных ионов Са2+ и Мg2+. В присутствии ионов Са2+ повышается АТФ-азная активность миозина и скорость гидролиза АТФ согласно уравнению
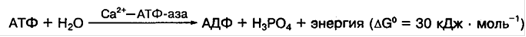
Химическая энергия АТФ, освобождающаяся в ходе данной ферментативной реакции, используется для изменения конформации белка миозина и генерации напряжения между толстыми и тонкими нитями миозина в сокращающейся мышце. Посредством ионов Мg2+ миозин способен присоединять молекулы АТФ и АДФ, а также взаимодействовать с молекулами актина, находящимися в составе тонких нитей миофибрилл.
Актин - второй сократительный белок мышц, который составляет основу тонких нитей (рис. 3). Известны две его формы - глобулярный G-актин и фибриллярный F-актин. Глобулярный актин - это шарообразный белок с молекулярной массой 42 000. На его долю приходится около 25 % общей массы мышечного белка. В присутствии Мg2+ актин подвергается нековалентной полимеризации с образованием нерастворимого филамента в виде спирали, получившего название F-актин. Обе формы актина не обладают ферментативной активностью. Каждая молекула G-актина способна связывать один ион Са2+, который играет важную роль в инициировании сокращения. Кроме того, молекула G-актина прочно связывает одну молекулу АТФ или АДФ. Связывание АТФ G-актином обычно сопровождается его полимеризацией с образованием F-актина и одновременным расщеплением АТФ до АДФ и фосфата. АДФ остается связанной с фибриллярным актином. Процесс полимеризации актина можно описать следующим уравнением:

актин активирует АТФ-азу миозина, что создает движущую силу процессу сокращения. Актин способен взаимодействовать с миозином, образуя актомиозиновый комплекс. Молярное соотношение актина и миозина в актомиозиновом комплексе - примерно 1:1. Нить F-актина может связывать большое число молекул миозина. Существенным свойством актомиозинового комплекса является диссоциация его в присутствии АТФ и Мg2+.
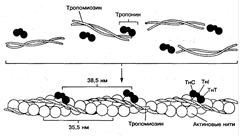
Рис. 3. Схема строения актиновой, или тонкой нити
 TimeBiology
TimeBiology
