.4.1Определение автолитической активности нейтральных протеаз
При определении автолитической активности нейтральных протеаз по методу Baundry (1981) и Nilsson, Karlsson (1986) измерения проводили на спектрофотометре СФ 46 при 280 нм.
Метод основан на способности ароматических аминокислот, поглощать ультрафиолетовый свет с максимумом поглощения при 280нм.
.4.2 Определение общей активности нейтральных протеаз
Общую активность нейтральных протеаз определяли модифицированным методом Лоури (Алейникова, Рубцова, 1988).
Приготовление субстрата
Взвешивали 1 г казеина и растворяли его в небольшом количестве (25 мл) гидроортофосфата натрия 0.05Н Na2HPO4 и доводят до кипения при постоянном помешивании. Затем в раствор добавляли 0.1 N NaOH, доводя рН до 7.4. Далее к раствору приливают дистиллят с соответствующим значением рН и доводли объем раствора до 100 мл. Дистиллят нужного значения рН также готовили, приливая к нему 0.1 N NaOH.
Состав проб для определения общей активности нейтральных протеаз
К 0.5 мл субстрата приливали 0.5 мл 10% гомогената и помещают на инкубацию в термостат при температуре 37°С на 60 минут. Затем к инкубату добавляли по 1 мл 0.3 N раствора ТХУ и выдерживали в течение 15 минут. Далее пробы фильтровали. К 0.5 мл фильтрата приливали 0.5 мл 0.0025 М раствора CuSO4, 4 мл 0.5 N раствора NaOH и 1 мл раствора Фолина. Через 20 минут проводится колориметрирование на фотоэлектроколориметре при λ=670 нм.
Контроль: 1 мл ТХУ+ 0.5 мл гомогената. Через 5 минут добавляли 0.5 мл субстрата.
Стандарт: 2 мМ раствор тирозина
Расчет активности фермента производится по формуле:
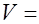
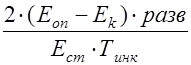 , где
, где
- активность фермента, мкмоль/гоп - экстинкция опытного раствора
Ек - экстинкция контроля
Ест - экстинкция стандартного раствора
Тинк - время инкубации, мин
Активность нейтральных протеаз выражали в мкмоль образовавшегося тирозина в расчете на 1 г ткани.
.4.3 Определение активности Са2+-зависимой нейтральной протеазы
Общую и Са2+-зависимую активность нейтральных протеаз определяли по методу Baundry (1981) и Nilsson, Karlsson (1986).
Гомогенаты тканей готовили на 50 мМ Трис- HCl буфере, рН=7.4.
Субстрат: 1 % раствор казеина, приготовленный в 0.1н растворе NaOH, нейтрализовали 0.2н раствором HCl.
Растворы: 1 мМ CaCl2 и 25мМ EGTA также готовили на 50 мМ Трис- HCl буфере, рН=7.4.
. Для определения общей активности нейтральных протеаз инкубационная смесь состояла:
.3 мл 1 % казеина
.5 мл 10% гомогената
.2 мл 1 мМ CaCl2
. Для определения Са2+-независимой активности нейтральных протеаз инкубационная смесь состояла:
.3 мл 1 % казеина
.5 мл 10% гомогената
.2 мл 25мМ EGTA
Пробы инкубировали 1 час при 37°С. Далее реакцию останавливали 1 мл 15% ТХУ. Пробы центрифугировали 15 мин при 3000 об/мин. 1 мл безбелкового центрифугата нейтрализовали 0.15 мл 10% раствора NaOH и в нем определяли количество фолинположительных соединений по методу Лоури. Оптическую плотность исследуемых образцов измеряли при λ=750 нм. Значения активности для Са2+-активируемой нейтральной протеазы типа I представляли собой разность оптических плотностей для общей и Са-независимой активности.
Активность выражали в мкмоль тирозина/100 мг белка за 1 час.
В качестве стандарта для построения калибровочной кривой использовали тирозин.
.4.4 Определение активности глицилглицин-дипептидазы
Активность глицилглицин дипептидазы определяли нингидриновым методом Ли и Такахаши с модификациями (Рева и др., 1982) в печени и в больших полушариях головного мозга бодрствовавших зимой и пробуждающихся весной сусликов. Каждую выделенную ткань взвешивали и гомогенизировали в холодном 0.25М растворе сахарозы в соотношении 1:9 (вес: объем) в стеклянном гомогенизаторе с тефлоновым пестиком. В среду гомогенизации добавляли 0.001М хлористый кобальт. Все операции проводили на холоду.
 TimeBiology
TimeBiology , где
, где